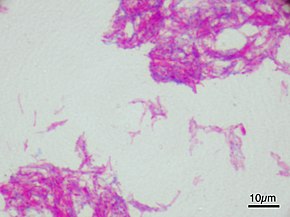
bio.wikisort.org - Bactérie
Mycobacterium bovis est la bactérie responsable d'une maladie dite « tuberculose bovine » (TB) qui affecte les bovins d'élevage et sauvages, mais aussi de nombreux animaux sauvages mammifères autres que les bovins. C'est l'une des formes du bacille de Koch (BK) responsables de diverses formes de tuberculose humaine. Elle en est très proche génétiquement, mais avec un agencement différent des gènes. C'est à partir d'une forme atténuée de ce bacille qu'est produit le vaccin BCG

(utilisé pour le vaccin BCG)
bovis
(souche atténuée utilisée pour le BCG)
| Règne | Bacteria |
|---|---|
| Embranchement | Actinobacteria |
| Ordre | Actinomycetales |
| Sous-ordre | Corynebacterineae |
| Famille | Mycobacteriaceae |
| Genre | Mycobacterium |
Espèce
Mycobacterium bovis peut franchir la barrière des espèces et infecter l’Homme[2]. Elle est donc classée parmi les « zoonoses » (infections naturellement transmissibles de l'animal à l'homme et vice versa).
On en connait de nombreuses souches, plus ou moins virulentes.
La recherche en termes de moyens de lutte épidémiologique a principalement porté sur des essais de vaccination[pas clair], puis l’éradication de porteurs sauvages (avec le risque quand il s’agit d’espèces territoriales (blaireau, opossum) de contribuer à élargir les zones touchées). La vaccination (qui s’est montrée bien plus efficace chez les renards sauvages que le piégeage dans le cas de la lutte contre la rage en Europe) a concerné le bétail, mais non les espèces sauvages.
Histoire épidémiologique
C'est une maladie probablement très ancienne, comme la tuberculose humaine.
Elle est courante chez les bovins, et durant la première moitié du XXe siècle a probablement causé une grande partie des pertes d'animaux de ferme.
En 1998, l’OMS a estimé que la tuberculose bovine (TB) avait tué environ 30 millions de personnes pendant la décennie 1990-1999, ce qui est moins que la tuberculose humaine (80 millions) mais reste très important. Pour ces deux maladies, la plupart des malades et des morts étaient dans les pays en développement.
La TB est présente chez de très nombreux animaux, dans la plupart des pays en développement, où la surveillance et le contrôle sont absents ou insuffisants, rendant la prospective écoépidémiologique très difficile.
De manière générale, la tuberculose préoccupe l'OMS, l'OIE et de nombreuses autorités sanitaires en raison d'une recrudescence dans certains pays, et d'une incidence croissante, notamment en raison du HIV/SIDA qui a aussi favorisé un développement nosocomial de la maladie[3].
Caractéristique
Bactériologie
Ce bacille est une bactérie aérobie à croissance lente ; il lui faut 16 à 20 heures pour produire une seule génération.
Il survit bien dans des tissus congelés[4], mais est détruit par la cuisson et divers biocides (ex tétraborate de sodium utilisé comme conservateur des tissus, dont en taxidermie)[4].
Génomique
Les chercheurs étudient avec attention le génome de cette bactérie, notamment parce qu'il est proche de la tuberculose humaine et que de nombreuses bactéries sont capables d'échanges horizontaux de gènes.
Le séquençage complet[5] de Mycobacterium bovis, publié en 2003 a permis de comparer ce bacille avec ceux de M. tuberculosis et M. leprae[6]. Il s'est montré étonnamment proche de la bactérie responsable de la tuberculose humaine, M. tuberculosis (semblable à 99,95 %[6]), mais une moindre redondance de l’information génétique fait qu'il a une taille plus petite[6]. Ce génome montre néanmoins une capacité plus large de codage de composants pour la paroi cellulaire et certaines protéines sécrétées[6]. Ceci évoque des interactions hôte–bacille plus complexes, et peut être un rôle dans l’ « évasion immunitaire » (capacité du bacille à échapper aux globules blancs)[6]. En outre, les gènes de M. bovis et de M. tuberculosis sont les mêmes, ce qui invite à penser que leur expression différentielle pourrait être un facteur-clé de leur pathogénicité et de leurs « tropismes d'accueil » (préférence en termes d’hôtes : humains, bovins ou autres mammifères)[6].
Ces découvertes confirment ou précisent des hypothèses faites dans les années 1990 sur la base des premiers éléments de cartographie génomique de M. bovis et M. tuberculosis[7].
Les chercheurs ont constaté que l'expression des gènes de ce bacille diffère fortement de celle de ceux de Mycobacterium tuberculosis responsable de la tuberculose humaine[8], bien que ces deux bactéries soient génétiquement très proches. Si l'on compare les deux bactéries au moment de leur croissance exponentielle, une expression différentielle des gènes est détectée dans 258 gènes, soit 6 % du génome total. Les principales variations concernent des gènes codant des protéines impliquées dans le métabolisme intermédiaire et la respiration, la construction de la paroi cellulaire et des protéines hypothétiques. Par rapport à M. tuberculosis, les généticiens notent l'expression d'un plus grand nombre de régulateurs de transcription chez M. bovis[8].
Survie de la bactérie hors de l’organisme, et dans certains produits laitiers
Les paramètres (pH, température, teneur en eau, teneur en sels, compétition avec d’autres organismes, présences de molécules naturellement bactéricides, etc.) en vertu desquels M. bovis peut ou pourrait se développer hors de l’organisme animal vivant, ne sont pas encore clairement connus.
La bactérie a montré en laboratoire certaines capacités à survivre un certain temps (très variable selon les conditions) hors de l’organisme. Mais elle ne se reproduit alors que très lentement, même dans de conditions jugées idéales de température et d’environnement.
Selon les données disponibles elle ne peut pas se reproduire dans le lait, mais elle peut y survivre un certain temps (Sinha, 1994), de même que dans certains fromages à base de laits cru non pasteurisés.
Ce temps de survie varie selon les produits et selon leurs conditions de fabrication. La littérature scientifique contient peu de preuves ou indices de survie de M. bovis dans des produits tels que la crème fraîche, le yaourt, le beurre et la crème glacée, mais les études les plus nombreuses ont concerné les fromages.
Une certaine survie a été observée dans le beurre, certains fromages et le fromage blanc (dans le fromage blanc au lait cru, la survie est encore observée à 14 jours, mais plus à 17 jours ; le produit n'est alors cependant plus adapté à la consommation car il peut commencer à être contaminé par des moisissures. Des études ont concerné l'emmental, le cheddar, le gruyère, le munster, le camembert et le bleu d'Auvergne (« fromage bleu ») ; l’emmental a été particulièrement bien étudié, et on a montré que le processus de production avait dans ce cas une incidence sur les capacités de survie de M. bovis, peut-être en raison de l’échaudage à 53 °C du caillé durant 30–40 minutes, ce qui ne détruit pas M. bovis mais semble affecter sa capacité à survivre lors de la maturation du fromage. Pour d'autres fromages à pâte dure tels le cheddar, une grande variabilité dans le temps est observée avec des bactéries viables durant 60 jours à plus de 200 jours dans certains cas. Cette variabilité pourrait refléter des différences de concentration de cet organisme dans le lait utilisé.
La bactérie meurt dans les fromages à longue maturation (certains fromages sont ainsi travaillés jusqu’à un an, voire plus, par exemple le cheddar ou la mimolette vieille et extra-vieille, etc.).
Hôtes
Cette maladie infectieuse chronique affecte une large gamme d'hôtes mammifères, dont les humains et les troupeaux de bovins[9],[10] ; la bactérie infecte aussi des herbivores aussi variés que les cervidés, les camélidés (Chameau, mais aussi lama, alpaga, vigogne ou guanaco), des omnivores tels que le porc et le sanglier, ou des carnivores tels le chien, le chat domestique ou le chat sauvage, le renard, le coyote, les mustélidés, l’opossum ou des rongeurs.
Par contre, pour des raisons encore mal comprises, il affecte plus rarement les équidés, les caprins (chèvres et chamois) ou les ovins[9],[10].
Pathogenèse, pathogénicité
Lésions et leurs distribution
Les lésions macroscopiques se présentent à l'autopsie comme des papilles ou grumeaux beiges ou jaunâtres répartis ou tapissant la surface de certaines organes internes. Chez les bovins, les tissus présentant le plus souvent des lésions macroscopiques visibles à l'examen post-mortem sont :
- certains tissus de la région rétropharyngée[11] ;
- des tissus de la zone parotide[11] ;
- des tissus trachéo-bronchiques[11] ;
- des tissus médiastinaux[11] ;
- des ganglions caudaux et cervicaux profonds[11] ;
- des ganglions lymphatiques subiliaques[11] ;
- les amygdales palatines[11] ;
- des tissus pulmonaires[11].
Les lésions macroscopiques et histologiques les plus visibles et fréquents touchent les ganglions lymphatiques de la région thoracique[11]. Des lésions semblables peuvent être observées chez d'autres mammifères tuberculeux dont le cerf[12]
Mycobacterium bovis peut néanmoins parfois être été isolé chez des bovins ne présentant aucune lésion macroscopique de la tuberculose. Parfois des lésions existent, mais dans une zone habituellement non examinée par le vétérinaire après abattage (ex : ganglion subiliaque)[11].
Dans la plupart des pays, la détection des lésions macroscopiques de la tuberculose lors de l'inspection vétérinaire des carcasses à l'abattoir est la principale méthode de détection des troupeaux de bovins (dont aux États-Unis dans les années 1990)[11].
Transmission
Cette bactérie peut se transmettre et se propager de nombreuses façons, dont par exemple dans l'air expiré, les mucus et crachats, l’urine, les matières fécales et le pus.
L'infection se produit si la bactérie est inhalée, ingérée ou introduite sous la peau ou dans le sang, et plus facilement chez les individus en état de déficience immunitaire.
La maladie peut donc être transmise par contact direct avec l’animal malade (ou son cadavre) ou plutôt via ses excrétats ou par inhalation d'aérosols, selon les espèces concernées.
Facteurs de virulence
Ils sont encore mal connus, mais la bactérie a probablement co-évolué avec les troupeaux depuis la naissance de l’élevage.
La maladie pourrait dans certains contextes jouer un rôle dans la limitation de la surpopulation de certaines espèces sauvages, notamment en l’absence de prédateurs. Mais l'introduction par l'homme d'un variant pathogène dans une région du monde où les animaux sont immunologiquement « naïfs » à son égard peut décimer un grand nombre d'animaux.
Une étude attentive de l'évolution de la régression de la tuberculose humaine depuis le XIXe siècle (fait constaté dans de nombreux pays), a montré qu’elle a objectivement significativement régressé avant la découverte des antituberculeux, et même de la vaccination. Les épidémiologistes supposent que ce sont les progrès de l’hygiène, de l’alimentation et des conditions de vie qui y ont contribué[13],[14],[15].
Épidémiologie humaine
Chez l'Homme, M. bovis est généralement transmise par du lait infecté[16], mais elle pourrait peut-être parfois aussi se propager par des microgouttelettes émises en aérosol par des animaux malades.
- Dans les régions et les pays riches, les infections humaines par Mycobacterium bovis sont devenues très rares, principalement grâce à la pasteurisation du lait, qui tue toutes les bactéries des laits infectés.
Les bovins sont testés au hasard pour la maladie et immédiatement abattus en cas d'infection (mais leur viande peut souvent encore être utilisés pour la consommation humaine). - Dans les pays dits en développement, la situation est très différente et généralement problématique[17]. La pasteurisation n'est pas systématique et là où elle est rare ou inexistante, M. bovis reste une cause relativement fréquente de tuberculose transmise par les bovins à l'homme[18].
Épidémiologie animale, écoépidémiologie et contrôle
Dans chaque région du monde, les conditions écoépidémiologiques changent, en raison d'une faune différente, de conditions d'élevages de bétail différentes, et aussi parfois peut-être en raison du caractère introduit et devenu invasif de certaines espèces ou de la présence d'autres mycobactéries qui pourraient interagir avec les souches connues de tuberculoses. Les situations décrites ci-dessous illustrent ces situations différentes dont certaines sont jugées préoccupantes par les vétérinaires et écologues et/ou par les médecins.
Nouvelle-Zélande
![Opossum Trichosurus vulpecula, introduit en Nouvelle-Zélande, et fréquemment porteur du bacille de la TB. Avant de mourir, il devient diurne, et tend à se rapprocher des maisons ou à pénétrer dans les élevages où il peut contribuer à colporter la maladie[19]. Il fait pour cette raison l'objet d'une campagne d'éradication en Nouvelle-Zélande](http://upload.wikimedia.org/wikipedia/commons/thumb/2/22/Trichosurus_vulpecula_1.jpg/220px-Trichosurus_vulpecula_1.jpg)

En Nouvelle-Zélande où les colons d'origine européenne ont introduit de nombreux troupeaux (ovins, chevaux et bovins, mais aussi 7 espèces différentes de cervidés), c'est un marsupial, l'opossum d'Australie (Trichosurus vulpecula), qui semble actuellement le principal vecteur de dispersion du microbe.
Cet opossum est également allochtone ; il a été introduit (à partir de l’Australie) par les colons, pour sa fourrure. Après s’être enfui d’élevages et/ou avoir été relâché par des propriétaires, il s’est ensuite reproduit dans la nature, où il a peu de prédateurs et de pathogènes mortels. Il est aujourd’hui considéré comme espèce invasive dans le pays. Il est de plus en plus porteurs de la bactérie de M. bovis (environ 38 % de ces opossums étudiés en étaient porteurs dans les zones déclarées à risque d’infection pour le bétail. Dans ces territoires déclarés à risque, près de 70 % des nouvelles infections de troupeaux semblent liées à l'opossum ou à des furets, qui eux-mêmes peuvent être infectés ou réinfectés par différents variants de la bactérie à partir des excréments des troupeaux, de cadavres, etc.
En 1993, une loi dite « Biosecurity Act 1993 » a imposé une stratégie nationale de lutte antiparasitaire visant à contrôler si puis éventuellement éradiquer la maladie dans toute la Nouvelle-Zélande. Dans ce cadre, un « Conseil de la santé animale (AHB, pour « Animal Health Board ») a été créé ; il gère d'une part un programme national de dépistage de la maladie dans le bétail néozélandais, et d'autre part un important programme de contrôle de l'opossum. Ces deux programmes combinés visent - avant 2026 - à éradiquer M. bovis chez les vecteurs sauvages dans un territoire de 2,5 millions d'hectares (soit un quart des zones classées à risques de la Nouvelle-Zéland). Il s’agira ensuite d'étendre les actions à l’ensemble du pays[20].
Ce programme dit « TB-free New Zealand » est considérée comme " leader " dans le monde en la matière [21]. Il a réussi à diviser par plus de 10 le taux de troupeaux infectés de cerfs et de bovins (passés de plus de 1700 troupeaux en 1994 à moins de 100 en ).
Une grande partie de ce succès est selon le gouvernement attribuable au « contrôle » des opossums qui a permis de réduire les contaminations croisées entre les populations-réservoir et de briser le « cycle » de la maladie. Par exemple, à Hohotaka, au centre de la Nouvelle-Zélande (île du Nord, de 1988 à 1994, le piégeage de cet animal en aurait réduit la densité de 87,5 %. Dans le même temps, l’incidence annuelle de la TB dans les troupeaux locaux de bovins a diminué d'un taux comparable (83,4 %)[22].
Les opossums sont piégés ou tués par empoisonnés par des appâts par exemple empoisonnés au fluoroacétate de sodium (dit « Poison 1080 » en Nouvelle-Zélande) ou au cyanure de potassium, déposés au sol ou largués par voie aérienne[23].
De 1979 à 1984, le contrôle de l'opossum par les autorités a été stoppé, au moins provisoirement, officiellement en raison d'un manque de financement. Le tests réguliers et fréquents faits chez les troupeaux de bovins ont montré que le nombre de bovins infectés a ensuite de nouveau augmenté (jusqu'en 1994) [24]. La part du territoire national où des animaux sauvages ont été trouvés porteurs de la maladie est passée d’environ 10 % à 40 %.
L’opossum d’Australie semble être un vecteur de transmission de la maladie particulièrement efficace en raison du comportement qu’il adopte quand il y succombe : en phase terminale de tuberculose, il présente un comportement anormalement erratique, et il adopte un comportement diurne de recherche de nourriture (alors qu’il est normalement nocturne). Il semble aussi rechercher des lieux où se tenir au chaud et se rapproche des habitations et élevage, on l'observe alors dans paddocks d'élevages, où il attire naturellement l'attention du bétail et des cerfs « curieux » (Le cerf a aussi été introduit en Nouvelle-Zélande pour en faire des élevages producteurs de viande, peaux, velours et trophées. Ce comportement a pu être filmé[19].
Il y a environ 9,3 millions de têtes de bétail dans le pays, réparties en 71 000 troupeaux et de nombreux cerfs sont élevés en enclos ou ont fondé des hardes dans la nature. Ils y sont cependant moins densément présents que les opossums et sont donc supposés moins contribuer à disséminer les bactéries[25]. La santé des cheptels de bovins et d'ovins est une préoccupation majeure pour les autorités sanitaires, mais elles doivent aussi tenir compte du lobby de la chasse : sept espèces de grands cervidés sont chassés dans le pays par environ 40 000 chasseurs (à comparer à la population totale de 4,3 millions d'habitants)[25] ; ces chasseurs abattent environ 70 000 cerfs par an[25]. Selon le gouvernement, sa stratégie de lutte antiparasitaire nationale 1996-2001 a atteint son objectif de réduction du nombre de troupeaux infectés (de 1700 à 800), mais sans réussir à empêcher l'expansion géographique des « zones à risque de vecteur » (qui avaient en 2001 gagné 40 % de tout le territoire néozélandais[25]. Une seconde stratégie nationale a donc été mise en œuvre pour la période 2001-2013, avec l'objectif d'atteindre une prévalence de moins de 0,2 % dans les élevages de bovins et de cerfs en 2013. Cette fois, un test de vaccination des opossums sauvage est envisagée, au moyen d'un vaccin de type BCG distribué par voie orale via des appâts dispersés dans la nature[25].
Royaume-Uni
![Au Royaume-Uni, le blaireau a été accusé d’être le principal vecteur de la bactérie ou responsable de sa transmission aux troupeaux, ce qui a justifié une intense campagne de piégeage. En 2008, le RSPCA (Royal Society for the Prevention of Cruelty to Animals) estimait cependant que seuls 4 à 6 % des blaireaux en étaient porteurs[26],[27]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/10/Badger-badger.jpg/220px-Badger-badger.jpg)
Prévalence et risques : Dans les années 1930, il a été estimé que 30 %[25] à 40 % (selon les sources) des bovins du Royaume-Uni étaient porteurs de cette bactérie. Et au sein de la population humaine, les médecins détectaient annuellement environ 50.000 nouveaux cas de TB humaine[28],[29].
Aujourd’hui, selon le DEFRA et l'Agence anglaise de protection de la santé (Health Protection Agency ou HPA), le risque pour une personne de contracter la tuberculose bovine en Grande-Bretagne est très faible ; selon la HPA, les ¾ des 440 cas humains qui lui ont été signalés de 1994 à 2006 étaient âgés (> 50 ans, nés avant 1960, suggérant que la maladie était une réactivation d’une infection ancienne) et 20 % des cas étaient des personnes d’origine étrangère, probablement porteuses d’une infection acquise dans un autre pays. Un petit nombre de cas concernaient des personnes ayant eu des contacts avec des animaux infectés.
Au Royaume-Uni, depuis 1994 il n'y a plus eu aucune preuve de cas humain pouvant être relié à une consommation récente de viande ou autre produit d’origine bovine[30].
Le cas du blaireau : À la fin du XXe siècle, il a été démontré au Royaume-Uni que le blaireau était sensible à la bactérie, qu'il peut acquérir à partir des troupeaux qu'il approche (ou d’autres espèces) et éventuellement retransmettre à d'autres bovins domestiques, mais son rôle précis dans la transmission est mal mesuré et a été ensuite fortement relativisé. Avant que l'importante de son rôle écoépidémiologique ait été évalué et comparé à celui d'autres espèces, à la demande d'éleveurs, des campagnes de battues, tirs et empoisonnements ou piégeage du blaireau ont été lancées.
Des blaireaux (Meles meles) avaient déjà été trouvés porteurs de cette bactérie il y a une trentaine d’années, sans susciter d'émoi particulier, car c'est aussi le cas de quelques autres espèces et de nombreuses d'autres n'ont pas fait l'objet de campagnes de tests.
Puis en 1997, dans un contexte de crise sanitaire notamment lié au prion pathogène dit de « la vache folle », un comité d'examen indépendant a estimé que cet animal pouvait significativement contribuer à diffuser cette zoonose entre les troupeaux de bovins[31]. Le blaireau a alors focalisé l'attention des éleveurs et chasseurs ; et il est devenu la source d'une longue dispute (non terminée) entre les défenseurs anglais de l'environnement et des animaux (désireux de sauver cette espèce déjà en régression ou disparue d’une partie de son aire naturelle de répartition) et les agriculteurs-éleveurs, auxquels se sont alliés de nombreux chasseurs (souhaitant être autorisés à détruire les blaireaux par abattage, piégeage et empoisonnement, afin de réduire les pertes dans les cheptel).
Une première grande étude randomisée sur les effets de ces abattages intensifs a été faite, dont les premiers résultats ont été publiés en 2007[32]. Cette étude a été conçue et supervisée par un groupe scientifique se présentant comme « indépendant » sur la TB, dit ISG (Independent Scientific Group) [33].
Elle est basée sur une vaste expériences de terrain, où 3 stratégies sont testées et comparées dans une zone d’étude de 3 000 km2, avec un effectif dédié de 180 employés et un budget annuel de 7 millions $ (non compris les frais de laboratoire)[34] ; la première stratégie consiste à éradiquer de manière proactive (en les recherchant et en les tuant), tous les blaireaux d’un large territoire, en observant si la maladie régresse dans les élevages de ces territoires. La seconde stratégie consiste à tuer les blaireaux uniquement en réponse à des infections de bétail et autour des élevages. La troisième (situation "témoin") consiste à ne pas tuer les blaireau[35]. Les effets éventuels des 3 « stratégies » sur la prévalence de la maladie dans les élevages ont été étudiés.
En 2007, dans son rapport final[36], l’ISG a conclu que :
- « Tout d'abord, alors que les blaireaux sont clairement une source de la tuberculose bovine, une évaluation minutieuse de nos propres données et de celles d’autres études indique que l’abattage des blaireaux ne peut apporter aucune contribution significative à la lutte contre la tuberculose dans le bétail en Grande-Bretagne, certains politiques envisagées étant même susceptibles d'aggraver les choses au lieu de les améliorer.
Deuxièmement, des faiblesses dans les modalités de test des bovins font que les bovins eux-mêmes contribuent de manière significative à la persistance et la propagation de la maladie dans tous les domaines où la tuberculose se produit, et dans certaines parties de la Grande-Bretagne, ils sont susceptibles d'être la principale source d'infection. Les conclusions scientifiques sont que l'incidence croissante de la maladie peut être inversée, et la répartition géographique contenue, par la seule application de mesures strictes de contrôle des bovins »[36].
Le , à la Chambre des lords, le ministre chargé de l'environnement, de l'alimentation et des affaires rurales (Lord Rooker) a dit au nom du gouvernement « Nous nous félicitons du rapport final du groupe scientifique indépendant, qui augmente encore les preuves disponibles. Nous étudions attentivement les questions soulevées par ce rapport et continuerons à travailler avec l'industrie, les conseillers du gouvernement et des experts scientifiques dans la prise de décisions politiques sur ces questions »[37], mais le message que le blaireau était responsable de la zoonose semble persister chez une partie de la population anglaise.
En 2008, le RSPCA (Royal Society for the Prevention of Cruelty to Animals) a insisté sur l'urgence de réviser cette politique de destruction qui n'est pas justifiables par une prévalence d'infection de seulement 4 à 6 % chez les blaireaux[26],[38].
Au Royaume-Uni (comme ailleurs), bien d'autres mammifères (dont rongeurs connus pour être vecteurs de nombreuses zoonoses, et sangliers plus mobiles que les blaireaux) se sont révélés être infectés par la bactérie M. bovis. Ils étaient cependant souvent moins fréquemment infectés que les bovins (et les blaireaux). On cherche maintenant à mieux comprendre l'écoépidémiologie de cette zoonose.
Les études vétérinaires, épidémiologiques et écoépidémiologiques faites en Angleterre et au Pays de Galles dans les années 2000 ont alors montré que dans certaines régions du Sud-Ouest de l'Angleterre, les cervidés, et notamment le daim, sans doute en raison de leur comportement grégaire et devenu moins mobiles et parfois en surdensité en raison de l'absence de grands prédateurs, d'apports artificiels de nourriture, de l'insularisation des massifs forestiers et d'une fragmentation croissante des forêts ont été impliqués en tant que réservoir animal et comme possible vecteur pour la transmission de la tuberculose bovine[39],[40].
Il semblerait même que dans certaines régions, le daim a une responsabilité plus importante dans la transmission aux bovins et comme réservoir sauvage que le blaireau[39],[40]
ratio coût/efficacité : Il a été estimé en 2005 que les tentatives d’éradication de la TB ont coûté au Royaume-Uni environ £ 90 millions, sans grands résultats depuis plusieurs années. D'un point de vue vétérinaire, ces financements auraient pu être ou pourraient être selon l'EFRA plus efficacement utilisés dans une stratégie multidimensionnelle croisant différentes méthodes de lutte contre la maladie, y compris dans la faune sauvage[41].
États-Unis d'Amérique et Canada
Dans ce pays, la bactérie M. bovis est endémique chez le cerf de Virginie (white-tailed deer; Odocoileus virginianus) dans la partie nord-est de Michigan[42],[43] et dans le nord du Minnesota et sporadiquement détecté au Mexique.
Seul le cerf de Virginie a été confirmé comme un hôte sauvage lors de l’épidémie de TB qui a touché le Michigan, bien que d'autres mammifères tels que le raton laveur (Procyon lotor), et l’opossum (Didelphis virginiana) et le coyote (Canis latrans) puissent aussi servir d'hôtes réservoir ou final [44] Le fait que le cerf de Virginie soit un réservoir de la bactérie M. bovis est présenté comme un obstacle important à l’éradication de la maladie dans le bétail aux États-Unis et d'autre part, la chasse du cerf est une source importante de revenus pour le commerce local ; ainsi, en 2008, 733 998 chasseurs licenciés ont tué environ 489 922 cerfs de Virginie lors d'opérations présentées comme destinées à gérer ou contrôler la propagation de la maladie en limitant le nombre de ces cerfs. Ces chasseurs ont acheté plus de 1,5 million de « bracelets » pour le cerf. En 2006, cette chasse aurait rapporté 507 000 000 dollars à l'Économie du Michigan [45].
Au Canada, les bisons sauvages et d'élevages font l'objet d'un suivi (comme pour la brucellose[46].
Dans le reste du monde
La maladie est observée chez les bovins dans le monde entier, mais certains pays ont été en mesure de fortement réduire ou limiter l'incidence de la maladie grâce à des opérations de contrôle de type « Test et réforme » appliquées au cheptel bovin (les animaux sont testés, et ceux qui portent la bactérie sont tués).
Europe : La plupart des pays de l'Europe et plusieurs pays des Caraïbes (dont Cuba) sont maintenant pratiquement exempts de M. bovis dans leurs élevages, mais des foyers sont périodiquement repérés dans les élevages, et la bactérie reste présente dans la nature. Ainsi une étude récente (2004) a porté en Espagne sur 6 espèces : le cerf (Cervus elaphus), le daim (Dama dama), le sanglier (Sus scrofa), le lynx ibérique (Lynx pardinus), le lièvre (Lepus europaeus) et les bovins (Bos taurus), dans plusieurs territoires. Ces 6 espèces de mammifères ont été choisis pour leurs positions-clé dans les écosystèmes et parce qu’ils ont des relations reconnues avec le bétail. Les résultats de l'étude ont confirmé les liens bétail-faune sauvage : les mêmes souches de M. bovis infectaient plusieurs espèces sauvages autour des troupeaux porteurs de la même souche, sans que l’on ait retrouvé un spoligotype[47] localement prédominant.
Les auteurs de cette étude estiment qu'il faut mieux comprendre la transmission et de la distribution de la maladie pour mieux cibler les mesures de contrôle de la TB[48].
Au Canada : Là ce sont le wapiti et le cerf de Virginie qui sont porteurs de la bactérie, notamment dans et autour du Parc national Riding Mountain dans le Manitoba. Pour améliorer le contrôle et éliminer la tuberculose bovine, l'Agence canadienne d'inspection des aliments (ACIA) a divisé le Manitoba en deux zones de gestion, avec un plan de lutte contre la tuberculose (RMEA) dans la zone où la maladie a été trouvée [49]. La maladie a aussi été trouvé dans les troupeaux de buffle africain en Afrique du Sud.
En Afrique du Sud : Des conséquences écologiques graves sont observées en depuis 1990. La TB s'y est rapidement développé dans la faune sauvage et a décimé les troupeaux sauvages de buffles autochtones (Syncerus caffer)[50] et leur principal prédateur le lion.
Les premiers cas n’ont été détectés chez le buffle qu’en 1990 dans le parc national Kruger[50] ; en 1999 plus de 70 % des buffles africains (Syncerus caffer) étaient tuberculeux dans le sud du Parc[51]. Une transmission inter-espèce vers le koudou et l'antilope, le chimpanzé, le babouin, ainsi que le lion a été constatée, avec des conséquences graves pour la biodiversité de la région[52],[53].
Vers une relativisation de l’importance de cette zoonose ?
- En 2010 dans la revue Trends in Microbiology, Paul et David Torgerson ont suggéré[54] de relativiser l’importance de cette maladie ; par rapport à l’ensemble des problèmes zoonotiques, elle apparaît être un problème négligeable pour la santé publique au Royaume-Uni, grâce au fait que l’essentiel du lait est maintenant presque toujours pasteurisé avant d’être utilisé et parce que la tuberculose bovine est très rarement propagée par aérosol du bétail aux humains, comme le montre le faible nombre d’éleveurs victimes de tuberculose bovine dans les pays développés. L’actuel programme de lutte contre la tuberculose bovine au Royaume-Uni - sous sa forme actuelle - est donc selon eux une mauvaise allocation des ressources et n'apporte aucun avantage à la société.
Il y a en outre peu d’indices de l’intérêt économique d’un tel programme, même pour l'industrie de l’élevage. Ceci est dû au fait que peu d'études ont porté sur les coûts directs et indirects de la tuberculose bovine sur la production animale[54]. La pasteurisation du lait ayant suffit à empêcher la presque totalité des cas de transmission de la tuberculose bovine à l'homme, il ne semble plus y avoir aucune justification économique ou sanitaire au plan tel qu’il a été conçu et mis en œuvre au Royaume-Uni[54].
- En , est parue la seconde édition d’un document de discussion intitulé « La tuberculose bovine, il est temps d' y repenser » [55]. Ce document a été publié par “Rethink Bovine TB”, un groupe ad hoc de chercheurs indépendants sur la tuberculose bovine, qui a à cette occasion examiné la politique conduite en Angleterre et au Pays de Galles relativement à la TB. Les auteurs proposent des solutions alternatives à la fois plus pratiques et économiquement plus rentables. Ils l'ont fait sur la base de données issues du Defra (qui a notamment reconnu[56] que presque tous les animaux à sang chaud sont sensible à l'infection, dont le chien et le chat et le porc/sanglier plus proche des troupeaux et de l'homme que le blaireau) et du travail des professeurs Paul et David Torgerson [54]. Le porc consomme du lait et des déchets de laiteries, et le sanglier se nourrit volontiers des cadavres qu'il peut trouver (le sanglier est toutefois peu présent.
- En Mars 2012, un des plus anciens « think tanks » du Royaume-Uni dans le domaine de la conservation de la nature, le Bow Group (créé en 1951) a publié un document intitulé Common sense and Bovine TB (Le bon-sens et la tuberculose bovine)[57] exhortant le gouvernement à revoir ses plans visant à continuer à exterminer des milliers de blaireaux pour lutter contre la tuberculose bovine.
Ce rapport s'appuie sur les études qui montrent qu'après plusieurs années d’abattage intensifs de blaireaux (dont 15 % sont porteurs du bacille[57] dans les régions où les élevages sont touchés), cette stratégie couteuse ne fonctionne pas (une campagne d’extermination à grande échelle de 11 000 blaireaux sur 9 ans, scientifiquement suivie, en lien avec les vétérinaires des régions concernées, ne s'est traduite que par une diminution de 12 à 16 % de la prévalence de la maladie dans les troupeaux[57], alors que des expérimentations de vaccination, à bien moindre coût ont abouti à faire diminuer la séroprévalence de 74 % chez le bétail)[57]. Elle pourrait même générer d’autre effets négatifs ; d'une part la perte de diversité génétique des blaireaux pourrait les rendre plus vulnérables à la maladie. D'autre part, chez les animaux territoriaux, moins il y a de groupes ayant constitué un territoire, plus un jeune de l'année pourra aller loin fonder un nouveau territoire, ce qui favorise une circulation plus rapide et sur de plus grandes distances des souches de microbes portées par ces blaireaux, y compris hors des zones ainsi « traitées »[57] ; de plus, il a été constaté que la densité de renards a augmenté là où les blaireaux ont été exterminés dans le sud-ouest de l'Angleterre, ce qui peut poser d'autres problèmes aux éleveurs[57] (de volaille notamment). Le rapport été rédigé par Graham Godwin – Pearson[58] du ‘Bow Group Council’ avec une relecture et des contributions de scientifiques spécialistes de premier plan de la tuberculose, dont le Dr John Krebs dit « Baron Krebs », éminent zoologue et éthologue anglais, concepteur de la plus grande étude réalisée sur les effets de la destruction massive de blaireaux en termes de lutte contre la Tuberculose bovine (« Randomised Badger Culling Trial » (ou RBCT)[59]. Ce rapport, qui divise le parlement a notamment été relayé par le journal The Guardian[60] et d’autres[61].
Vers une relativisation de l’importance du blaireau et des animaux sauvages dans la transmission de cette zoonose ?
Des preuves et indices semblent disculper la faune sauvage en tant que cause première ou importante par rapport aux pratiques d'élevages. De plus la vaccination a montré dans le cas de la rage une efficacité très supérieure aux tentatives d'éradication des animaux qui avaient été supposés responsables des épidémies dans les élevages. Dans un autre domaine, mais avec des enjeux en partie similaires, les études écoépidémiologiques concernant le H5N1 et la grippe comme zoonose ont aussi pointé l'importance des transferts d'animaux malades par l'homme, de la gestion des déchets animaux (épandage, gestion des cadavres, etc.) et des pratiques d'élevage dans les épidémies touchant les élevages.
- Le blaireau a souffert de l'image de vecteur biologique principal de la tuberculose bovine qu'on lui a indument accolé durant une dizaine d'années, et qu'il gardera probablement quelque temps (malgré les données scientifiques disponibles, et sans doute aussi à cause d'une histoire plus ancienne d'espèce mal-aimée) :
Il était autrefois classé parmi les "puants". Sa destruction voire sa persécution a (comme dans le cas du renard et des mustélidés dans quelques pays) été une sorte de sport populaire, en Grande-Bretagne du XVIIIe au XIXe siècle. Des groupes de villageois bouchaient les entrées de son terrier, le déterraient et le battaient à mort.
Cette pratique a été interdite en 1835, par une loi combattant la cruauté à l'égard des animaux (proposée par la Société royale pour la prévention de la cruauté envers les animaux ou RSPCA) ; le blaireau est donc théoriquement une espèce protégée dans tout le pays depuis une loi de 1911 dite Protection of Animals Act 1911[62], théoriquement confortée dans le cadre de la Convention de Bernes, sur la protection de la vie sauvage[63] et un traitement cruel infligé à un blaireau en lui causant la mort et un délit au regard du " Protection of Badgers Act " de 1992 (jusqu'à 6 mois de prison et £ 5000 d'amendes et des travaux de service communautaire)[64]. Cependant, des enquêtes conduites en 2009 par le Sunday Times et la BBC ont révélé que des battues et le déterrage de blaireaux étaient encore illégalement pratiqués au Royaume-Uni et en Irlande (où des lois similaires le protègent)[65],[66]. Les battues et le déterrage sont largement considérés comme une activité cruelle et clandestine[67].
Sa protection n'est cependant pas absolue et des dérogations (licences de destruction) peuvent être fournies de manière ponctuelle et limitées, par Natural England, par le gouvernement de l'Assemblée galloise et par le Countryside Council for Wales, mais dans des circonstances exceptionnelles et justifiées, et sans pratiques de cruauté.
Ces activités illégales de destruction sont depuis quelques années traitées avec sérieux avec la RSPCA et d'autres groupes contribuant aux affaires pénales, y compris en s'appuyant sur des techniques médico-légales et l'analyse d'ADN[68]. - Même s'il avait une mauvaise image chez certains éleveurs et chasseurs, en plus d'être une espèce fortement protégée le blaireau est aussi une espèce emblématique[69],[70] et populaire dans la littérature et la psyché nationale[71],[72].
- Après presque dix ans de pratique de destruction presque systématique dans le sud-ouest de l'Angleterre, sa destruction est devenue très impopulaire dans le public ; un sondage indépendant cité en 2012 par le Bow Group a montré que 81 % des Anglais interrogés étaient opposés au plan gouvernemental de destruction des blaireaux.
Lutte contre la maladie
Comme c'est une zoonose, les stratégies de lutte devraient à la fois porter sur le contrôle de la bactéries dans les élevages et dans la faune sauvage et domestique (chiens, chats, etc.). Cependant la prévalence de la maladie dans la nature, et les relations entre faune sauvage et bétail sont encore mal connues.
La tuberculose est l'un des premiers bacilles découverts et étudiée par les hygiénistes.
En 1901 Von Behring, assistant de Robert Koch et premier lauréat du prix Nobel de physiologie ou médecine, déclarait lors de la cérémonie de remise du prix : « Comme vous le savez, la tuberculose chez les bovins est l'une des maladies infectieuses les plus dommageables qui puisse affecter l'agriculture » [73].
Un siècle plus tard, l'incidence de la maladie était fortement réduite ou contrôlée dans la plupart des pays riches, avec parfois des pics 2,8 % des bovins en l’an 2000 en Grande-Bretagne sauf dans le sud-ouest où ce taux est plus important, avec une augmentation exponentielle de cas en 10 ans malgré la destruction des blaireaux qui étaient suspectés de véhiculer le bacille entre troupeaux [74].
Pour mieux contrôler la maladie, il faudrait aussi mieux la contrôler dans la nature, chez les espèces dites « réservoir ». Les tentatives d'éradication des espèces porteuses s’avèrent souvent être des échecs et être couteuses, voire avoir un effet inverse à ce qui était espéré, en étendant par exemple les zones touchées. La vaccination est une piste qui semble potentiellement efficace
Diagnostic
L'examen clinique d'un animal vivant permet éventuellement de détecter des lésions évoquant la tuberculose[4]. L'examen histopathologique augmente la confiance du diagnostic[4], mais seul l'isolement bactériologique de Mycobacterium bovis de la lésion permet de poser le diagnostic définitif[4]. La sensibilité de l'examen post mortem brut est affectée par la méthode employée et les sites anatomiques examinés[4].
Les tests
Ils sont nécessaires pour le dépistage sur animal vivant ou la recherche des causes sur des animaux morts. Des faux positifs et des faux négatifs sont possibles. Si un test était positif et que l'examen post-mortem ne trouve pas de lésions caractéristiques de la tuberculose, cela peut être dû à une infection précoce, une technique d'autopsie inadaptée ou à une infection par des mycobactéries autres que M. bovis[4]. Un examen bactériologique est nécessaire pour confirmer ou non la présence de la bactérie[4].
Sur animal vivant, les tests les plus pratiqués aujourd'hui sont :
- le test d'intradermotuberculination comparative (IDC) : Ce test est basé sur la comparaison de réactions allergiques à la suite de l’injection (intradermale), à un même bovin, de tuberculines PPD (Dérivé Protéique Purifié) aviaire (préparée à partir de Mycobacterium avium) et bovine (préparée à partir de Mycobacterium bovis). En Europe, une directive européenne (64/432/CEE) décrit comment il doit être mis en œuvre ;
- Le test à l'interféron γ : C'est un test immunologique. Il détecte l'interféron γ qui est sécrété par les lymphocytes T sensibilisés après stimulation par un antigène particulier. Pour rechercher la tuberculose bovine, un échantillon de sang du bovin à tester est mis en incubation en contact avec de la tuberculine (aviaire ou bovine), puis on récupère le surnageant plasmatique et on y dose l'interféron γ par un test Elisa (test immuno-enzymologique). Il est considéré comme ayant une assez bonne sensibilité et une bonne spécificité [75], mais est coûteux (30 à 60 € par test) en 2010.
- test « anamnestic ELISA » mesurant pour un échantillon de sérum une réponse humorale. Il est intéressant pour détecter les animaux suspecté d'êtres « anergiques » dans un foyer de TB ("anergique" signifie que l'animal est infecté mais qu'il ne peut plus être dépisté par les tests habituels basés sur une réponse cellulaire, ce qui se produit souvent en cas d'infection avancée
- test post-mortem ; En Europe, ils relèvent du règlement no 854/2004 depuis 2004 et relevaient antérieurement de la directive européenne 64/433/CEE), qui prescrivent une inspection vétérinaire des cadavres ; Corner estimait[4] en 1994 qu'il suffit de bien examiner au moins 6 paires de nœuds lymphatiques, des poumons et des ganglions mésentériques pour repérer 95 % des lésions macroscopiques dues à la tuberculose, mais 70 % des animaux ayant réagi à un test et ensuite soumis à inspection post-mortem ne présentent qu'une lésion unique (9,8 % de ces lésions simples seraient retrouvées dans les poumons) ; il est donc facile de ne pas détecter une lésion sur un animal pourtant infecté[76].
Dépistage
Il varie beaucoup selon les lieux et les moments. Il n'es pas ou très peu pratiqué dans les pays dits pauvres ou émergents.
Dans les pays dits riches ou industriels, il est souvent pratiqué en routine, mais plus fréquent dans les zones classées à risques ou dans les années suivant l'émergence d'un nouveau foyer et dans les zones périphériques à ce foyer. À titre d'exemple, dans les années 2000 au Royaume-Uni, tout bovin (sauf certains bœufs en engraissement, devait subir un dépistage obligatoire tous les 1, 2, 3 ou 4 ans selon la zone où est situé l'élevage. L'intervalle entre deux dépistages variait selon la zone (selon le degré de risque estimé en fonction de la déclaration ou non de foyers les 2, 4 ou 6 années précédentes dans la zone, avec réévaluation annuelle (ou à l'occasion d'un nouveau foyer de BT) par l'autorité sanitaire (Animal Health)[77]
Stratégie européenne
L'Union européenne a une stratégie visant à limiter voire éradiquer la maladie dans les États-membres, par un strict contrôle des maladies dans les échanges intracommunautaires de bétail. Pour des raisons de sécurité sanitaire, les États-membres doivent pratiquer dans les élevage jugés indemnes de maladie le dépistage pré mouvement (c'est-à-dire chez l'éleveur avant transfert vers l'acheteur), 30 jours avant toute exportation vers un autre pays européen. Il existe aussi un dépistage aléatoire ou post-mouvement (chez l'acheteur).
Mais dans les années 2000, la situation sanitaire des troupeaux varie encore selon les pays et les conditions environnementales, conduisant à une situation épidémiologique hétérogène[78].
Les 10 nouveaux entrants avaient en 2004 presque éradiqué la maladie (0,2 % de prévalence[79]), mais des préoccupations persistent sur les risques de détection tardive ou l’apparition de nouveaux variants plus virulents ou l’introduction de microbes avec des animaux importés[79].
Vaccination de la faune sauvage, des animaux
Elle semble être une piste potentiellement la plus efficace, en accompagnement d'une meilleure politiques de gestion de risques sanitaires dans les filières de l'élevage ; d'autant que d'importants progrès ont été récemment accomplis en matière de vaccination contre la tuberculose[80] et que de nombreux auteurs ont conclu dès la fin du XXe siècle, d'après les retours d’expérience sur la rage, d'autres maladie et selon les données disponibles sur la tuberculose, que l’approche la plus prometteuse était la vaccination des animaux sauvages en accompagnement de la lutte contre la maladie dans les élevages. Par exemple, le blaireau pourrait en Angleterre être vacciné[81]. Ceci est encore plus vrai dans les pays en développement où la mise en place d’un système complet de veille sanitaire et de tracabilité serait plus couteuse et difficile[81].
Pourtant, la vaccination pose encore deux problèmes :
- des problèmes juridiques : « Actuellement, les obligations commerciales internationales interdisent l'utilisation de vaccins contre la tuberculose chez les bovins domestiques et les cerfs élevés et dont la viande ou des reproducteurs pourraient circuler ou être exportés, afin que les tests puissent ne pas confondre la réponse immunitaire d’un animal à la vrai maladie et à un inoculat de vaccin »[43], de manière à préserver le statut “indemne” du pays au regard de cette maladie, qui permet l'exportation qui est dans certaines régions une nécessité économiques (par exemple, les éleveurs de Dordogne exportent 80 % de leurs bovins vers l'Italie, chacun de ces animaux doit être indemnes de la TB) ;
- un problème technique potentiel (concernant certaines régions, si l'on utilise un vaccin habituel de type BCG) : L'efficacité du BCG « classique » sur l'homme et l'animal varie significativement selon des facteurs qui incluent des facteurs environnementaux et régionaux[82]. Dans quelques populations humaines, le vaccin s'est montré inefficace[82]. La première hypothèse explicative a été que cette variation était induite par des interactions entre le vaccin et des mycobactéries communes de l'environnement de ces populations (la tuberculose est aussi due à une mycobactérie)[82].
Cette hypothèse a été confirmé chez la souris de laboratoire en 2002 : l'exposition à certaines mycobactéries environnementales peut effectivement entraîner une large réponse immunitaire, rapidement activée par l’individu vacciné par le BCG, et qui contrôle la multiplication du vaccin ; la réponse immunitaire est alors transitoire et peut ne pas conférer d'immunité protectrice durable contre la tuberculose humaine[82].
Cependant l'efficacité des « vaccins sous-unitaires » contre la tuberculose n'est pas affectée[82].
Mycobacterium_bovis et la Vaccination par le BCG
Un premier vaccin fut expérimenté en 1886 par Vittorio Cavagnis[83] tandis qu'à cette même époque Robert Koch tenta vainement de développer un sérum curatif basé sur la tuberculine[84].
En 1902, à partir d'un bacille d'origine humaine atténué, Behring tente de produire un vaccin contre la tuberculose bovine : le « bovovaccin ».
Behring proposa également, sans succès, la « tuberculase »[85].
Toujours dans le domaine vétérinaire, Koch essaya le tauruman. Pour mémoire, il faut aussi citer le sérum de Marmorek ( 1904), le sérum de Maragliano, les sérums de Richet et Héricourt, ainsi que les tentatives peu honnêtes de Friedmann (en) et de Spahlinger[86].
C'est en 1921 qu'Albert Calmette et Camille Guérin de l'Institut Pasteur de Lille essayent avec succès le premier vaccin contre la tuberculose sur lequel ils travaillaient depuis 1908 - qui était conçu pour être un vaccin vétérinaire. Baptisé BCG (pour Bacille de Calmette et Guérin ou Bilié de Calmette et Guérin) ce vaccin issu d'une souche vivante atténuée de Mycobacterium bovis deviendra obligatoire en France en 1950.
Enjeux économiques
La mortalité et morbidité des animaux d'un troupeau ont un coût pour l'éleveur.
Les stratégies de lutte contre la maladie pourraient s'appuyer sur les soins vétérinaires et la vaccination, mais
- Les soins distribués aux animaux malades de la tuberculose bovine sont interdits. Un argument souvent présenté est qu'il s'agit d'éviter le développement d’antibiorésistance et de situation de nosocomialité chez les animaux ;
- La vaccination des animaux (bétail ou espèces dites « réservoir » sauvages est également interdite, au profit de l'élimination des animaux et troupeaux malades, car le statut « indemne de tuberculose bovine » d'un pays est jugé plus important par ses autorités (un pays est officiellement classé indemne si moins de 0,1 % de son cheptel national est infecté). Il est en réalité possible d'acquérir une qualification « indemne de tuberculose » par cheptel permettant de valider localement le statut sanitaire des animaux, mais une qualification nationale est considérée comme plus rassurante pour les partenaires commerciaux du pays[87]. Elle n'implique cependant pas que la maladie ne soit pas présente chez les animaux sauvages.
Notes et références
- doi : 10.1099/00207713-20-3-273 & ATCC 19210
- John M. Grange, Malcolm D. Yates and Isabel N. de Kantor., « Guidelines for speciation within the Mycobacterium tuberculosis complex. Second edition » [PDF], World Health Organization., (consulté le )
- Bouvet E, Casalino E, Mendoza-Sassi G, Lariven S, Vallee E, Pernet M, et al. A nosocomial outbreak of multidrug-resistant Mycobacterium bovis among HIV- infected patients. A case-control study. AIDS 1993 ; 7:1453-60
- Corner LA (1994), Post-mort em diagnosis of Mycobacterium bovis infection in cattle. Veterinary Microbiology , 40 , 50-63 (résumé)
- Génome de Mycobacterium bovis
- Thierry Garnier& al. (2003), [The complete genome sequence of Mycobacterium bovis], PNAS June 24, 2003 vol. 100 no. 13 7877-7882 ; enligne ; 2003-06-03 ; Doi: 10.1073/pnas.1130426100 (résumé)
- Philipp WJNair S, Guglielmi G, Lagranderie M, Gicquel B, Cole ST (1996), Physical mapping of Mycobacterium bovis BCG pasteur reveals differences from the genome map of Mycobacterium tuberculosis H37Rv and from M. bovis, . Microbiology. 1996 Nov; 142 ( Pt 11):3135-45.(résumé)
- Germán Rehren, Shaun Walters, Patricia Fontan, Issar Smith, Ana M. Zárraga (2007), Differential gene expression between Mycobacterium bovis and Mycobacterium tuberculosis, Tuberculosis, Vol.87, N°4, Juillet 2007, Pages 347-359 (résumé)
- Delahay, R.J., De Leeuw, A.N.S., Barlow, A.M., Clifton-Hadley, R.S. and Cheeseman, C.L. (2002). The status of Mycobacterium bovis infection in UK wild mammals : A review.. The Veterinary Journal, 164: 90-105
- Phillips, C.J.C., Foster, C.R.W., Morris, P.A. and Teverson R. (2001). The transmission of Mycobacterium bovis infection to cattle = La transmission de l'infection à Mycobacterium bovis aux bovins. Research in Veterinary Science, 74: 1-15
- Whipple DL, Bolin CA, Miller JM. (1996), Distribution of lesions in cattle infected with Mycobacterium bovis J Vet Diagn Invest. 1996 Jul; 8(3):351-4 (résumé)
- État du Michigan, Bovine Tuberculosis Information for Hunters = Tuberculose bovine, information pour les chasseurs
- R. Beaglehole, R. Bonita, T. Kjellström - Éléments d'épidémiologie éd. OMS 1994, p 85.
- (en)[PDF]Environmental Justice, Science, and Public Health, Steve Wing
- Michel Georget, Vaccinations, éd. Dangles, p. 237
- Bovine Tuberculosis, www.lung.ca, consulté 2013-09-04
- O Cosivi & al. (1998), Zoonotic tuberculosis due to Mycobacterium bovis in developing countries ; Emerging Infectious Diseases ; Vol. 4, No. 1, janv-mars 1998 PDF, 12p
- O'Reilly LM, Daborn CJ., « The epidemiology of Mycobacterium bovis infections in animals and man: a review », Tuber Lung Dis., vol. 76, no Suppl 1, , p. 1–46 (PMID 7579326, DOI 10.1016/0962-8479(95)90591-X)
- Dr Paul Livingstone, Letter to the editor ; Gisborne Herald, 2011-05-26
- Programme « TBfree New Zealand »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (en)
- Bovine TB control : What are other countries doing ? , 2011-07-21
- J.M. Kean, « Evaluating potential sources of bovine tuberculosis infection in a New Zealand cattle herd », New Zealand Journal of Agricultural Research, New Zealand Journal of Agricultural Research., vol. 42, , p. 101 (DOI 10.1080/00288233.1999.9513358)
- « The use of 1080 for pest control - 3.1 Possums as reservoirs of bovine tuberculosis »,
- « Future freedom from bovine TB, Graham Nugent (Landcare Research) » [archive du ],
- Dr. Graham J. Hickling & Michael S. VanderKlok D.V.M. (2003), International Review of Bovine Tuberculosis in the State of Michigan ; Report of the Meeting of the Bovine Tuberculosis International Review Team ; conférence qui s'est tenue du 16 au 18 oct 2003 à San Diego (Californie), doc word, voir p 17 et 18/35
- Perkins, Edward: Bovine TB - A Commentary. Farm Law, issue 148 (Dec 2008), pages 15-20. ISSN 0964-8488.
- Gray, Louise: New head of RSPCA vows to take on Government over hunting and badger cull ; The Telegraph, publié 2012-09-29, consulté 2012-09-29.
- Reynolds D, « A review of tuberculosis science and policy in Great Britain », Vet Microbiol, vol. 112, nos 2–4, , p. 119–126 (PMID 16343818, DOI 10.1016/j.vetmic.2005.11.042)
- Ano (1965). « Bovine tuberculosis. In: A centenary of animal health 1865-1965”. London: Ministry of Agriculture,Fisheries and Food;
- ACM/1021 (2010), Advisory commitee on the microbiological safety of food ; Discussion paper, the possible health risks to consumers associated with ‘’Mycobacterium bovis’’ ans milk. Partie II d’une évaluation sur les risques lies à la TB au Royaume-Uni – Unpasterised milk products , food.gov.uk, PDF, 16 pages (en)
- (en) Krebs JR, Anderson T et Clutton-Brock WT, Bovine tuberculosis in cattle and badgers: an independent scientific review, London, Ministry of Agriculture, Fisheries and Food,
- defra, « Bovine TB: Randomised Badger Culling Trial (RBCT) » (consulté le )
- defra, « Bovine TB: The Independent Scientific Group on Cattle TB » (consulté le )
- Dr. Graham J. Hickling & Michael S. VanderKlok D.V.M. (2003), International Review of Bovine Tuberculosis in the State of Michigan ; Report of the Meeting of the Bovine Tuberculosis International Review Team ; conférence qui s'est tenue du 16 au 18 oct 2003 à San Diego (Californie), doc Word, voir p 19/35
- Dr. Graham J. Hickling & Michael S. VanderKlok D.V.M. (2003), International Review of Bovine Tuberculosis in the State of Michigan ; Report of the Meeting of the Bovine Tuberculosis International Review Team ; conférence qui s'est tenue du 16 au 18 oct 2003 à San Diego (Californie), doc word, voir p 19/35
- (en) « Independent Scientific Group on Cattle TB (2007), « Bovine TB: The Scientific Evidence »; Final Report of the Independent Scientific Group on Cattle TB Presented to the Secretary of State for Environment, Food and Rural Affairs The Rt Hon David Miliband MP, June 2007 » [PDF] (consulté le )
- Daily Hansard, « Daily Hansard, House of Lords; Thursday, 26 July 2007. » (consulté le )
- Gray, Louise: New head of RSPCA vows to take on Government over hunting and badger cull ; The Telegraph, publié 2012-09-29, consulté 2012-09-29
- R. J. Delahay, G. C. Smith, A. M. Barlow, N. Walker, A. Harris, R. S. Clifton-Hadley et C. L. Cheeseman, « Bovine tuberculosis infection in wild mammals in the South-West region of England: A survey of prevalence and a semi-quantitative assessment of the relative risks to cattle = L'infection de la tuberculose bovine chez les mammifères sauvages de la région du Sud - Ouest de l'Angleterre : Une enquête de prévalence et une évaluation semi- quantitative des risques liés aux bovins », The Veterinary Journal, vol. 173, no 2, , p. 287–301 (PMID 16434219, DOI 10.1016/j.tvjl.2005.11.011)
- A. I. Ward, G. C. Smith, T. R. Etherington et R. J. Delahay, « Estimating the risk of cattle exposure to tuberculosis posed by wild deer relative to badgers in England and Wales = Estimation des risques d'exposition des bovins à la tuberculose via les cerfs sauvages, par rapport aux blaireaux, en Angleterre et au Pays de Galles », Journal of Wildlife Diseases, vol. 45, no 4, , p. 1104–1120 (PMID 19901384)
- The Veterinary Record, « Bovine TB: EFRACom calls for a multifaceted approach using all available methods », The Veterinary Record, vol. 162, , p. 258–259
- Payeur JB, Church S, Mosher L, Robinson-Dunn B, Schmitt S, Whipple D (2002); “Review Bovine tuberculosis in Michigan wildlife “ ; Ann N Y Acad Sci. 2002 Oct; 969():259-61.
- Dr. Graham J. Hickling & Michael S. VanderKlok D.V.M. (2003), International Review of Bovine Tuberculosis in the State of Michigan ; Report of the Meeting of the Bovine Tuberculosis International Review Team ; conférence qui s'est tenue du 16 au 18 oct 2003 à San Diego (Californie), doc word, 35 p
- Witmer, G., A. E. Fine, J. Gionfriddo, M. Pipas, K. Shively, K. Piccolo, and P. Burke. 2010. Epizootiological survey of Mycobasterium bovis in wildlife and farm environments in Northern Michigan. Journal of Wildlife Disease, 46: 368-378.
- D. J. O’Brien, S. M. Schmitt, S. D. Fitzgerald et D. E. Berry, « Management of bovine tuberculosis in Michigan wildlife: Current status and near term prospects », Veterinary Microbiology, vol. 151, , p. 179–187 (PMID 21414734, DOI 10.1016/j.vetmic.2011.02.042)
- Parcs Canada, Parc national du Canada Elk Island ; Gestion des maladies chez le bison, Gestion du bison au Canada, consulté 2013-09-04
- spoligotype, sur le Wiktionnaire
- N Montero, C Sánchez, M Galka, Consuelo Delso, Julio Álvarez, Beatriz Romero, Javier Bezos, Ana I. Vela, Victor Briones, Ana Mateos and Lucas Domínguez (2004), Bovine tuberculosis (Mycobacterium bovis) in wildlife in Spain, J. Clin. Microbiol. June 2004 vol. 42 no. 6 2602-2608 ; doi: 10.1128/JCM.42.6.2602-2608.2004 (résumé)
- " Bovine Tuberculosis (TB) Management - In the Riding Mountain Area, Manitoba Conservation
- Rodwell TC, Kriek NP, Bengis RG, Whyte IJ, Viljoen PC, de Vos V, Boyce (2001),Prevalence of bovine tuberculosis in African buffalo at Kruger National Park : WM. J Wildl Dis. 2001 Apr; 37(2):258-64.
- De Vos V, Bengis RG, Kriek NP, Michel A, Keet DF, Raath JP, Huchzermeyer HF. Onderstepoort (2001),”The epidemiology of tuberculosis in free-ranging African buffalo (Syncerus caffer) in the Kruger National Park, South Africa” ; J Vet Res. 2001 Jun; 68(2):119-30.
- Weyer, K., Fourie, P. B., Durrheim, D., Lancaster, J., Haslov, K. & Bryden, H. (1999), Mycobacterium bovis as a zoonosis in the Kruger National Park, South Africa ; Int. J. Tuberc. Lung Dis. 3, 1113-1119. (résumé)
- Michel AL, Coetzee ML, Keet DF, Maré L, Warren R, Cooper D, Bengis RG, Kremer K, van Helden P. (2009), Molecular epidemiology of Mycobacterium bovis isolates from free-ranging wildlife in South African game reserves ; Vet Microbiol. 2009 Feb 2; 133(4):335-43. Epub 2008-08-05
- Torgerson, PR, « Public health and bovine tuberculosis: what's all the fuss about? », Trends in Microbiology, vol. 18, no 2, , p. 67–72 (PMID 19944609, DOI 10.1016/j.tim.2009.11.002)
- http://www.rethinkbtb.org/a_better-way.html 'Bovine TB, Time for a Rethink « La tuberculose bovine, il est temps d' y repenser » ] (en)
- Defra (2013), TB in non-bovine species, consulté 2013-09-01
- Bow Group (2012), Common sense and Bovine TB (Le bon-sens et la tuberculose bovine), PDF, 30 p
- Graham Godwin – Pearson est chercheur (“Research Fellow ») en politiques de l’environnement et du développement soutenable, mais également élu depuis 2001. Spécialiste des questions de conservation de la nature (il est aussi président du « Redland Conservatives » et DCP du « Clifton Conservatives », et a été prédident du « Bristol West Conservatives (2010-2013) »
- « Bow Group urges the Government to Scrap Badger Cull plans = Le Bow Group exhorte le gouvernement à abandonne ses plans de destruction du blaireau », Bow Publishing, (consulté le )
- « Badger Cull divides Tories », The Guardian, (consulté le )
- « Now even Tories are calling for the badger cull to be scrapped », Western Morning News, (consulté le )
- Protection of Animals Act 1911, lien: www.legislation.gov.uk/ukpga/Geo5/1-2/27
- Convention on the Conservation of European Wildlife and Natural Habitats 1979, Lien : conventions.coe.int/treaty/en/Treaties/Html/104.htm
- Protection of Badgers Act 1992, available here: www.legislati on.gov.uk/ukpga/1992/51
- Badger and deer crime on the rise, BBC News 4 Jun 2009, lien : news.bbc.co.uk/1/hi/scotland/8082232.stm
- Exposed: The evil world of badger baiting, Sunday Times 22 février 009, lien : www. timesonline.co.uk/tol/news/world /ireland/article5781271.ec
- Griffiths, H.I., Thomas, D.H. (1997 ), The conservation and management of the European badger (Meles meles) ; Council of Europe (ISBN 9287134472)
- Badgers & the law (Le blaireau et la loi), lien : www.rspca.org.uk/allaboutanimals/wildlife/laws/badgers
- Badger Cull: Are we silly to be so sentimental ? BBC 19 Nov 2010, (Lien)
- Varley, S., Badgerʼs Parting Gifts 1992 (ISBN 0006643175)
- Lewis, C.S., Prince Caspian: The Return to Narnia 1951 (ISBN 0-02-044430-3)
- Dann, C. (1979), The Animals of Farthing Wood (ISBN 0434934305)
- www.nobel.se/medicine/laureates/1901
- DEFRA, Animal Health
- (Vordermeier et al., 2006)
- Good M. (2008) Control of bTB in Ireland ; 4 juin 2008.
- Source : Site internet du Defra ; Mars 2008)
- F.J. Reviriego et J.P. Vermeersch (2006) “Towards eradication of bovine tuberculosis in the European Union” ; 4th International Conference on Mycobacterium bovis ; Veterinary Microbiology ; Volume 112, Issues 2–4, 25 February 2006, Pages 101–109
- Ivo Pavlik (2006) "The experience of new European Union Member States concerning the control of bovine tuberculosis » ; 4th International Conference on Mycobacterium bovis ; Veterinary Microbiology ; Volume 112, Issues 2–4, 25 February 2006, Pages 221–230 (résumé)
- B.M. Buddle, D.N. Wedlock et M. Denis (2006), « Progress in the development of tuberculosis vaccines for cattle and wildlife » ; Veterinary Microbiology (résumé
- Buddle, B. M., M. A. Skinner et M. A. Chambers (2000), Immunological approaches to the control of tuberculosis in wildlife reservoirs. Vet. Immunol. Immunopathol. 74:1-16.(résumé)
- L Brandt, JF Cunha, AW Olsen, B Chilima, Penny Hirsch, Rui Appelberg et Peter Andersen (2002), Failure of the Mycobacterium bovis BCG vaccine: some species of environmental mycobacteria block multiplication of BCG and induction of protective immunity to Tuberculosis ; Infection and Immunitéy,. February 2002 vol. 70 no. 2 672-678 ; doi:10.1128/IAI.70.2.672-678.2002
- (fr) « Gazette hebdomadaire de médecine et de chirurgie. - 1887. - série 2, tome 24 », sur web2.bium.univ-paris5.fr (consulté le )
- (fr) « Robert Koch and the pressures of scientific research: tuberculosis and tuberculin. C Gradmann, page 2 », sur www.ncbi.nlm.nih.gov (consulté le )
- (fr)[PDF]« Medecine : Futur Anterieur Ou Les Perspectives D’avenir Inspirees Par Deux Grandes Decouvertes Scientifiques Du XIXe Siecle : La Theorie Microbienne Et Les Rayons X », sur www.bium.univ-paris5.fr (consulté le )
- (en)[PDF]« Editorial Section page 617 », sur ajph.aphapublications.org (consulté le )
- Agra presse (2012), La France attentive aux nouveaux cas récents de tuberculose bovine ; 04 juin 2012 consulté 2013-09-01
Voir aussi
Articles connexes
- Mycobactéries
- Tuberculose
- Robert Koch
- Maladies infectieuses
- Élevage
- médecine vétérinaire
- Zoonose
Bibliographie
- (en) M. L. Thom, M. McAulay, H. M. Vordermeier, D. Clifford, R. G. Hewinson, B. Villarreal-Ramos e tJ. C. Hope (2012), “Duration of Immunity against Mycobacterium bovis following Neonatal Vaccination with Bacillus Calmette-Guerin Danish: Significant Protection against Infection at 12, but Not 24, Months” ; Clin Vaccine Immunol August 2012 vol. 19 no. 8 1254-1260 ; doi:10.1128/CVI.00301-12 (Résumé)
- (en) O Cosivi & al. (1998), Zoonotic tuberculosis due to Mycobacterium bovis in developing countries ; Emerging Infectious Diseases ; Vol. 4, No. 1, janv- PDF, 12p
- (en) Richard Meyer, The Fate of the Badger, Fire-raven Writing, , 2e éd. (1re éd. 1986)
Liens externes
- (en) TB free New Zealand Programme de contrôle de la TB en Nouvelle-Zélande
- (en) Informations sur la TB (poison, Opossum comme réservoir du bacille), Department of Conservation website ;
- (en) Informations sur la TB et le poison 1080 (Nouvelle-Zélande)
- Portail de la médecine vétérinaire
- Portail de l’agriculture et l’agronomie
- Portail des maladies infectieuses
На других языках
- [fr] Mycobacterium bovis
[ru] Mycobacterium bovis
Mycobacterium bovis (лат.) — вид медленно растущих (от 16 до 20 часов) микобактерий, является возбудителем туберкулёза у крупного рогатого скота (известен также, как «бычий туберкулёз», «жемчужная болезнь»).Другой контент может иметь иную лицензию. Перед использованием материалов сайта WikiSort.org внимательно изучите правила лицензирования конкретных элементов наполнения сайта.
WikiSort.org - проект по пересортировке и дополнению контента Википедии